1 ml otopine sadrži 100 mg humanog normalnog imunoglobulina (uključujući najmanje 95% IgG). Raspodjela podrazreda IgG: IgG1 - približno 60%, IgG2 - približno 32%, IgG3 - približno 7%, IgG4 - približno 1%. Maksimalni sadržaj IgA nije veći od 0,4 mg. PH otopine je 4,5 - 5,0; njegova osmolalnost je ≥ 240 mOsmol / kg. Ovaj lijek ne sadrži više od 0,03 mmol (0,69 mg) natrija po ml otopine. Pripravak sadrži maltozu.
| Ime | Sadržaj paketa | Djelatna tvar | Cijena 100% | Zadnja promjena |
| Octagam 10% | cipela. 200 ml, sol. do inf. | Imunoglobulin normalan čovjek | 2019-04-05 |
Akcijski
Ljudski normalni imunoglobulin sastoji se uglavnom od funkcionalno nepromijenjenog imunoglobulina G (IgG) sa širokim spektrom antitijela protiv zaraznih sredstava. Ima raspodjelu podrazreda imunoglobulina G blisko proporcionalnu onoj u nativnoj ljudskoj plazmi. Dovoljno visoke doze humanog normalnog imunoglobulina mogu vratiti abnormalno niske razine imunoglobulina G u normalne vrijednosti. Mehanizam djelovanja lijeka na druge indikacije osim nadomjesne terapije nije u potpunosti razjašnjen, ali poznato je da uključuje imunomodulatorne učinke. Ljudski normalni imunoglobulin je odmah i potpuno bioraspoloživ u cirkulaciji primatelja nakon intravenske primjene. Relativno se brzo raspoređuje između plazme i izvanstanične tekućine; nakon 3-5 dana uspostavlja se stanje ravnoteže između intra- i ekstravaskularnih odjeljaka. Poluvrijeme IgG u imunokompromitiranih bolesnika nakon primjene pripravka kreće se od 26 do 41 dan. Poluvrijeme može varirati od pacijenta do pacijenta, posebno u slučajevima primarne imunodeficijencije. Imunoglobulin G (IgG) i njegovi kompleksi razgrađuju se u stanicama retikuloendotelnog sustava.
Doziranje
Intravenski. Odrasli i djeca (0-18 godina). Zamjensku terapiju treba započeti i nadgledati pod nadzorom liječnika s iskustvom u liječenju imunodeficijencije. Doza i režim doziranja ovise o indikaciji. U zamjenskoj terapiji, dozu će možda trebati prilagoditi pacijentu, ovisno o farmakokinetičkom i kliničkom odgovoru. Rasporedi doziranja u nastavku su smjernice. Zamjenska terapija kod primarnih imunodeficijencija. Režim doziranja trebao bi postići najnižu razinu IgG (izmjerenu prije sljedeće infuzije) od najmanje 5-6 g / l. Potrebno je 3-6 mjeseci od početka liječenja da se ispravi nedostatak antitijela. Preporučena početna doza je 0,4-0,8 g / kg. primijenjen jednom, tada se koristi 0,2 g / kg tjelesne težine. svaka 3-4 tjedna Potrebna je doza od 0,2-0,8 g / kg tjelesne težine / mjesec da bi se postigla razina IgG od 5-6 g / l. Interval između doza nakon postizanja stabilnog stanja je 3-4 tjedna.Određivanje i procjena najnižih koncentracija treba izvršiti u odnosu na učestalost infekcije. Možda će biti potrebno povećati dozu i težiti višim najnižim razinama kako bi se smanjila stopa zaraze. Hipogamaglobulinemija i rekurentne bakterijske infekcije u bolesnika s kroničnom limfocitnom leukemijom kod kojih antibiotska profilaktička terapija nije dala zadovoljavajuće rezultate; hipogamaglobulinemija i rekurentne bakterijske infekcije u bolesnika s multiplim mijelomom u fazi visoravni koji nisu reagirali na pneumokoknu imunizaciju; Kongenitalna AIDS s ponavljajućim bakterijskim infekcijama: preporučena doza je 0,2-0,4 g / kg. svaka 3-4 tjedna Hipogamaglobulinemija u bolesnika nakon alogene transplantacije hematopoetskih matičnih stanica: preporučena doza je 0,2-0,4 g / kg svaka 3-4 tjedna. Najniže razine treba održavati iznad 5 g / l. Primarna imunološka trombocitopenija. Postoje dva alternativna rasporeda liječenja: 0,8-1 g / kg 1. dana liječenja; ova se doza može ponoviti jednom u roku od 3 dana ili 0,4 g / kg / 24 h tijekom 2-5 dana. Liječenje se može ponoviti ako se bolest ponovi. Guillain Barreov sindrom: 0,4 g / kg tt dnevno tijekom 5 dana. Kawasaki bolest: 1,6-2 g / kg u podijeljenim dozama tijekom 2-5 dana ili pojedinačnoj dozi od 2 g / kg tjelesne težine. Pacijente treba liječiti acetilsalicilnom kiselinom. Način darivanja. Primijeniti intravenski kao infuziju početnom brzinom od 0,01 ml / kg tjelesne težine / min tijekom 30 minuta. Ako se dobro podnosi, brzina primjene može se postupno povećavati na najviše 0,12 ml / kg / min.
Indikacije
Zamjenska terapija u odraslih, djece i adolescenata (0-18 godina). Primarni sindromi imunodeficijencije s oštećenom proizvodnjom antitijela. Hipogamaglobulinemija i ponovljene bakterijske infekcije u bolesnika s kroničnom limfocitnom leukemijom kod kojih antibiotska profilaksa nije bila uspješna. Hipogamaglobulinemija i ponovljene bakterijske infekcije u bolesnika s multiplim mijelomom u fazi visoravni koji nisu reagirali na pneumokoknu imunizaciju. Hipogamaglobulinemija u bolesnika nakon alogene transplantacije hematopoetskih matičnih stanica (HSCT). Kongenitalna AIDS s ponavljajućim bakterijskim infekcijama. Imunomodulacija u odraslih i djece i adolescenata (0-18 godina). Primarna imunološka trombocitopenija (ITP) u bolesnika s visokim rizikom od krvarenja ili prije operacije radi povećanja broja trombocita u krvi. Ekipa Guillain Barréa. Kawasaki bolest.
Kontraindikacije
Preosjetljivost na djelatnu tvar ili bilo koju pomoćnu tvar. Preosjetljivost na humane imunoglobuline, posebno u bolesnika s antitijelima protiv IgA.
Mjere predostrožnosti
Nužno je slijediti upute za doziranje i strogo se pridržavati propisane brzine infuzije. Bolesnike treba pažljivo nadzirati zbog nuspojava tijekom infuzije. Određene nuspojave mogu biti češće pri visokoj brzini infuzije ili u bolesnika koji prvi put primaju ljudski normalni imunoglobulin ili, u rijetkim slučajevima, pri prelasku s humanog normalnog imunoglobulina na drugi pripravak ili nakon duže pauze od prethodne infuzije. Potencijalne komplikacije mogu se izbjeći osiguravanjem da pacijenti: nisu preosjetljivi na ljudski normalni imunoglobulin početnim davanjem pripravka polagano (0,01 do 0,02 ml / kg tjelesne težine / min); pažljivo se nadgledaju simptomi tijekom razdoblja infuzije.Konkretno, pacijente koji prethodno nisu liječeni humanim normalnim imunoglobulinom, pacijente koji su prethodno primali alternativni pripravak IVIg ili ako je prošlo puno vremena od prethodne infuzije, treba nadzirati tijekom prve infuzije i tijekom prvog sata nakon završetka. Sve ostale bolesnike treba pratiti najmanje 20 minuta. nakon primjene pripravka. Ako se javi nuspojava, brzinu infuzije mora se smanjiti ili prekinuti. U slučaju šoka treba započeti odgovarajuću medicinsku pomoć. U svih bolesnika, intravenska primjena Ig zahtijeva: primjerenu hidrataciju bolesnika prije početka intravenske infuzije Ig, praćenje diureze, praćenje serumskog kreatinina, izbjegavanje istodobne primjene diuretika petlje. Istinske reakcije preosjetljivosti su rijetke: mogu se javiti u bolesnika koji imaju antitijela protiv IgA. Lijek nije indiciran u bolesnika sa selektivnim nedostatkom IgA kod kojih je nedostatak IgA jedina abnormalnost. U rijetkim slučajevima, primjena humanog imunoglobulina može uzrokovati pad krvnog tlaka s anafilaktičkom reakcijom, čak i kod onih pacijenata koji su prethodno tolerirali liječenje humanim imunoglobulinom. Infuzije IVIg treba koristiti s oprezom kod bolesnika s prekomjernom tjelesnom težinom i kod bolesnika s postojećim čimbenicima rizika za trombotičke događaje kao što su starost, hipertenzija, dijabetes, vaskularne bolesti ili povijest trombotičkih događaja, stečenih ili urođenih trombotičkih poremećaja, produljene imobilizacije, teških hipovolemija, bolesti tijekom kojih se povećava viskoznost krvi. Zabilježeni su slučajevi akutnog zatajenja bubrega u bolesnika liječenih pripravcima IVIg, u većini slučajeva identificirani su čimbenici rizika kao što je već zatajenje bubrega, dijabetes melitus, hipovolemija, prekomjerna tjelesna težina, istodobni nefrotoksični lijekovi. U slučajevima bubrežne disfunkcije, treba razmotriti prekid terapije IVIg. Izvješća o disfunkciji i akutnom zatajenju bubrega povezana su s upotrebom mnogih odobrenih IVIg proizvoda (koji sadrže saharozu, glukozu, maltozu kao pomoćne tvari), ali pripravci koji sadrže saharozu kao stabilizator doprinijeli su nesrazmjerno ukupnom broju slučajeva; u rizičnih bolesnika može se razmotriti primjena IVIg proizvoda koji ne sadrže ove pomoćne tvari. U bolesnika s visokim rizikom od akutnog zatajenja bubrega ili trombemboličkih nuspojava, IVIg pripravke treba primjenjivati s minimalnom brzinom infuzije i izvodivom dozom. Zabilježen je sindrom aseptičnog meningitisa (AMS) u vezi s terapijom IVIg; Prekid terapije IVIg rezultirao je remisijom AMS-a u roku od nekoliko dana bez posljedica. Primatelje IVIg treba nadzirati zbog kliničkih znakova i simptoma hemolize. Unatoč standardnim mjerama za prevenciju infekcija koje se šire pripravcima na bazi ljudske krvi ili plazme, prilikom primjene takvih pripravaka ne može se u potpunosti isključiti mogućnost prijenosa infektivnih sredstava. To se također odnosi na nepoznate ili nove viruse ili druge patogene. Korištene metode smatraju se učinkovitima u sprečavanju prijenosa virusa s ovojnicom kao što su HIV, HBV i HCV, ali mogu biti ograničene upotrebe protiv virusa bez ovojnice kao što su HAV i parvovirus B19. Kliničko iskustvo pokazuje da se imunoglobulinski pripravci ne prenose virus hepatitisa A ili parvovirus B19. Također se pretpostavlja da prisutnost antitijela sadržanih u tim pripravcima pridonosi sigurnosti ovih pripravaka. Postoje izvještaji o nekardiogenom plućnom edemu (akutna posttransfuzijska ozljeda pluća - teška respiratorna insuficijencija, plućni edem, hipoksemija, normalna funkcija lijeve klijetke i vrućica, 1-6 sati nakon transfuzije) kod bolesnika liječenih IVIG-om, pri primjeni Octagama treba biti oprezan iako do sada nije primijećen takav slučaj nakon primjene ovog pripravka. Kardiovaskularno (volumsko) preopterećenje može se dogoditi tijekom primjene IVIG-a, kada volumen pripravka i drugih primijenjenih infuzija uzrokuje akutnu hipervolemiju i akutni plućni edem. Ovaj lijek ne sadrži više od 0,03 mmol (0,69 mg) natrija po ml otopine. To treba uzeti u obzir kod pacijenata na dijeti s kontroliranim natrijem.
Nepoželjna aktivnost
Često: preosjetljivost, glavobolja, mučnina, vrućica, umor, reakcije na mjestu injekcije. Manje često: ekcemi, bolovi u leđima, hladnoća, bolovi u prsima. Vrlo rijetko: leukopenija, hemolitička anemija, anafilaktički šok, anafilaktička reakcija, anafilaktoidna reakcija, angioedem, edem lica, zbunjeno stanje, nemir, anksioznost, cerebralni infarkt, aseptični meningitis, gubitak svijesti, poremećaj govora, migrena, vrtoglavica, hipoestezija, parestezija, fotofobija, drhtanje, oštećenje vida, infarkt miokarda, angina pektoris, bradikardija, tahikardija, lupanje srca, cijanoza, tromboza, kolaps cirkulacije, zatajenje periferne cirkulacije, flebitis, hipotenzija, hipertenzija, bljedilo, zatajenje disanja, , plućni edem, bronhospazam, hipoksija, dispneja, kašalj, povraćanje, proljev, bolovi u trbuhu, ljuštenje kože, urtikarija, osip, eritematozni osip, dermatitis, pruritus, alopecija, eritem, artralgija, mialgija, bolovi u ekstremitetima, bolovi u vratu , grčevi mišića, mišićna slabost, ukočenost mišićno-koštanog sustava, akutno zatajenje bubrega, bol u bubrezima k, edemi, simptomi slični gripi, vrućica, crvenilo, osjećaj hladnoće, vrućina, znojenje, malaksalost, nelagoda u prsima, astenija, letargija, osjećaj pečenja, povećani jetreni enzimi, lažno pozitivan test glukoze u krvi.
Trudnoća i dojenje
Trudnoća. Sigurnost pripravka u trudnica nije utvrđena u kontroliranim kliničkim ispitivanjima. Pripravak treba s posebnom pažnjom primjenjivati trudnicama i dojiljama. Pripravci IVIg prolaze kroz placentu, što se povećava tijekom trećeg tromjesečja. Kliničko iskustvo s primjenom imunoglobulina ukazuje da oni nemaju štetnih učinaka na tijek trudnoće, razvoj fetusa ili novorođenčeta. Dojenje. Imunoglobulini se izlučuju u majčino mlijeko i mogu pomoći u zaštiti novorođenčeta od patogena koji prodiru u sluznicu. Plodnost. Kliničko iskustvo s primjenom imunoglobulina sugerira da se ne mogu očekivati štetni učinci na plodnost.
Komentari
Određene nuspojave mogu oslabiti sposobnost upravljanja vozilima ili rada sa strojevima. Pacijenti koji tijekom liječenja imaju nuspojave trebali bi pričekati da se povuku prije vožnje ili upravljanja strojevima. Nakon primjene imunoglobulina, može doći do prolaznog povećanja razine različitih pasivno prenesenih antitijela u krvi pacijenta, što može dovesti do lažno pozitivnih rezultata u serološkim testovima. Pasivno prenesena antitijela na antigene eritrocita, npr. A, B, D, mogu ometati rezultate seroloških testova, npr. Izravnog antiglobulinskog testa (Coombsov test). U bolesnika liječenih pripravcima IVIG, indeks sedimentacije crvenih krvnih stanica (ESR) može biti lažno povišen (neupalno povećanje). Pripravak sadrži maltozu, pa se stoga određivanje koncentracije glukoze mora provoditi metodama specifičnim za glukozu.
Interakcije
Imunoglobulini sadržani u pripravku mogu u razdoblju od 6 tjedana do 3 mjeseca smanjiti učinkovitost živih, oslabljenih cjepiva protiv ospica, zaušnjaka, rubeole ili vodenih kozica (treba održavati tromjesečni interval između primjene i cijepljenja; u slučaju cijepljenja protiv ospica, slabost) Imunološki odgovor može trajati do godinu dana, stoga se preporučuje da se prije cijepljenja izmjere titri antitijela na ospice). Pripravak se ne smije miješati s drugim lijekovima.
Pripravak sadrži tvar: Imunoglobulin normalan čovjek
Povrat lijeka: NE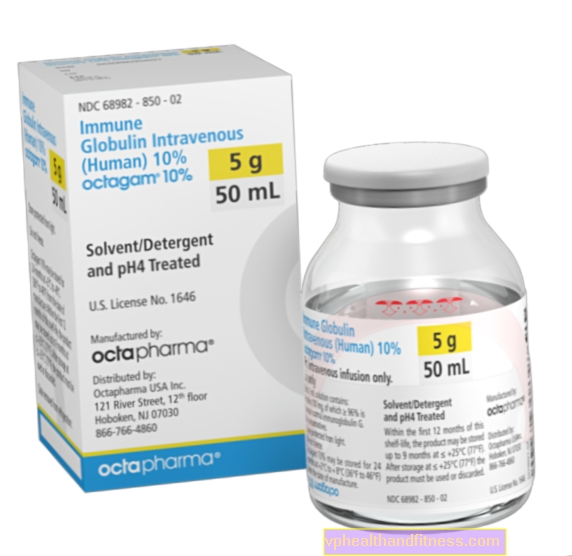


.jpg)















-przyczyny-i-leczenie.jpg)